RESEARCH
細胞老化グループ
生物が次世代に子孫を確実に残すためには、個体を形成する各組織が機能的でなければならない。実際、子孫をつくる生殖期にある個体では、各組織が損傷を受ければ、直ちに修復されるなど、常に組織恒常性が保たれている。一方で、生殖期を終えた個体は経年的に組織恒常性を失い、やがてそれら組織の機能不全による死を迎える。この過程はいわゆる老化 (とくに、個体老化) であり、線虫からわれわれヒトに至るまで進化的に保存されている。
ヒト正常線維芽細胞をはじめとする正常分裂細胞は、試験管内で培養を続けると、最初は活発に細胞分裂を行い、指数関数的にその細胞数を増加させるが、一定回数細胞分裂した後、やがて非可逆的に細胞分裂を停止する。このとき、増殖を停止した細胞はいかなる細胞増殖刺激にも応答を示さず、また、特徴的なトランスクリプトーム変化による機能不全にある。この現象は細胞老化 (cellular senescence) とよばれ、上皮細胞や造血細胞といった再生組織にあっては、生涯にわたるのべ細胞分裂回数の増加に伴うテロメア長の短小化によって、正常細胞は細胞老化に陥る。個体レベルでの老化細胞の蓄積が、加齢性疾患の発症を促進し個体老化を引き起こす一因であることは、老化細胞を選択的に排除可能な遺伝子改変マウスを用いた実験により証明されている。
また、細胞老化はテロメア短小化のみならず、がん遺伝子の活性化など、さまざまな非致死性のストレスによって比較的短期間に誘導される。細胞老化は、加齢性疾患を生じやすくする一方で、生理的な抗腫瘍機構 (たとえば、傷ついた細胞の過剰な細胞増殖を抑止する) として機能する。さらに、発生過程や組織が損傷した際、細胞老化は炎症性サイトカインや成長因子の分泌を介して、組織構築および修復に重要な役割を担っている。以上のことから、再生組織における細胞老化は、個体維持にとって正負両方の作用をもたらす遺伝的にプログラムされた現象として理解される。
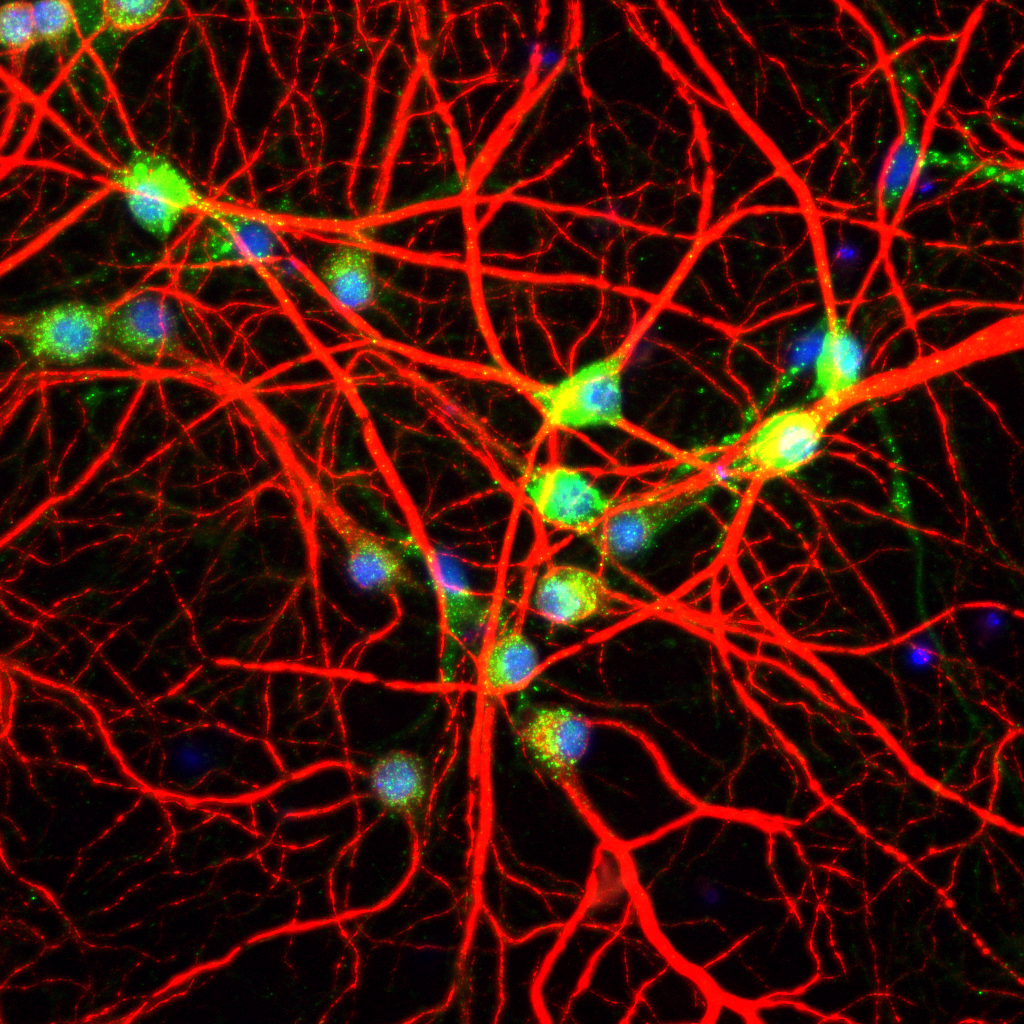
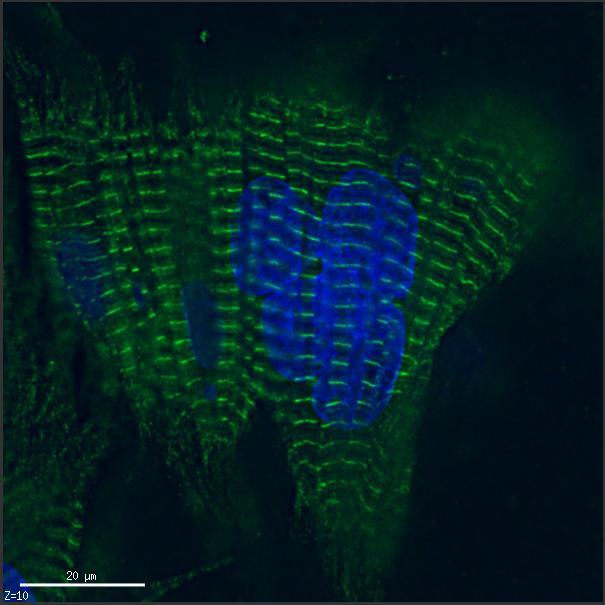
脳や心臓などの非再生組織は、生理的に細胞分裂を停止した状態にある終末分化細胞 (それぞれ、神経細胞および心筋細胞)を構成要素とし、それら細胞の生存が脳および心機能に必要不可欠である。非分裂性細胞はそれぞれの組織において、時に一生涯という長期間維持され続けており、その間は常に非致死性のストレスにさらされている。しかし、細胞老化は非可逆的な細胞増殖停止をもって判定されるため、それは正常再生組織でのみ起こると現在考えられている。近年、私たちは、正常分裂細胞に加えて、神経細胞や心筋細胞といった非分裂性細胞の初代細胞培養系を確立し、非致死性ストレスが非分裂性細胞において細胞老化を生じることを明らかにしつつある。
これらの研究成果を踏まえ、現在細胞老化グループでは、二面性を示す細胞老化が再生・非再生組織の組織恒常性に果たす役割、また、両組織に普遍的なそれら分子基盤の解明を目指している。本研究が、個体の生理的老化過程、また、生理的から病理的老化 (がん、心疾患、神経変性疾患など) への変遷過程における分子機構についての見識を深め、老化関連疾患の新規治療法開発につながると期待している。ひいては、個体維持にとって二面性をもつ細胞老化の理解は、個体の老化がなぜ進化的に保存されているのかという生物学的問いに対する解を導くかもしれない。