RESEARCH
テロメアグループ
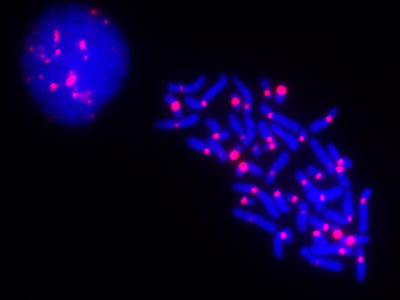
全ての真核生物は線状ゲノムDNAをもち[1]、その末端部分に相当するクロマチンはテロメアと呼ばれている。2本のはだかのDNAは容易に結合して1本になるが、生物が持つ線状ゲノムDNAが互いに結合することなくそれぞれが安定に維持されているのは、テロメアがDNA末端を末端結合やDNA消化反応から保護しているためである。細胞増殖に伴うDNA複製では、テロメアDNAの最末端は完全には複製されない(末端複製問題)。その結果、ヒト正常細胞は細胞分裂のたびに少しずつテロメアDNAが短小化する。テロメアはゲノムの安定な維持に必要であるため、細胞は、テロメア短小化によってその機能が失われる前にそれを認識し、積極的に細胞分裂を抑制する。この状態は細胞老化と呼ばれ、個体老化の少なくとも一部の原因であることが知られている。
石川博士は約30年にわたって、テロメアがどのように維持されるのか、その破綻がどのような病態につながるのかを分裂酵母、カエル卵抽出液、哺乳類培養細胞、遺伝子改変マウスを使って分子レベルで研究を行ってきた。その結果、哺乳類テロメレース活性の検出[2]、ヒトテロメレース構成因子の発見[3]、テロメア機能喪失による環状染色体形成の発見と、染色体が線状であることが減数分裂(有性生殖)に必須であることの証明[4]、末端複製問題の試験管内再構成[5]、新規テロメア因子の発見と機能解析[6-9]、テロメレース活性制御機構[10, 11]、エピジェネティックなテロメア機能維持[12]、テロメレース非依存的テロメア維持機構[13]などの成果をあげてきた。
このように、これまでテロメア機能としてDNA末端保護とテロメレース反応を含めたDNA複製反応を中心に解析を進めてきたが、現在、細胞の老化やがん化などの高次機能における役割を検討している。
補足:テロメアとは?
生物の設計図である遺伝情報は、DNAにコードされ、さらに複数のタンパク質との複合体である「染色体」という物質として核内に収容されています。我々の細胞は常に外的および内的ストレスにさらされています。例えば紫外線や放射線などは、染色体DNAに直接作用し、時にはDNA二本鎖を切断してしまいます。これはDSB (Double Strand Break)と呼ばれ、放っておくと遺伝情報を大幅に失ってしまう可能性のある重篤な傷害です。そこで細胞は、DSBでできたDNA切断末端を認識して、細胞がそれ以上増えないようにブレーキをかけます(細胞周期停止)。そうして時間を稼いでいる間に切断末端どうしを繋げて傷を修復します。
さて、原核生物の染色体が環状であるのに対して、我々を含む真核生物の染色体は線状です。つまり1本の染色体につき、2つの端があります。この自然末端は、DSBでできた切断末端と同じ構造であるため、そのままだと細胞は上記の細胞周期停止や修復経路を活性化してしまいます。そこで自然末端をDSB末端と区別して保護しているのがテロメアです。
引用文献
1. Ishikawa, F. and T. Naito, Why do we have linear chromosomes? A matter of Adam and Eve. Mutat Res, 1999. 434(2): p. 99-107.
2. Tatematsu, K., et al., A novel quantitative 'stretch PCR assay', that detects a dramatic increase in telomerase activity during the progression of myeloid leukemias. Oncogene, 1996. 13(10): p. 2265-74.
3. Nakayama, J., et al., Telomerase activation by hTRT in human normal fibroblasts and hepatocellular carcinomas. Nat Genet, 1998. 18(1): p. 65-8.
4. Naito, T., A. Matsuura, and F. Ishikawa, Circular chromosome formation in a fission yeast mutant defective in two ATM homologues. Nat Genet, 1998. 20(2): p. 203-6.
5. Ohki, R., T. Tsurimoto, and F. Ishikawa, In vitro reconstitution of the end replication problem. Mol Cell Biol, 2001. 21(17): p. 5753-66.
6. Kanoh, J. and F. Ishikawa, spRap1 and spRif1, recruited to telomeres by Taz1, are essential for telomere function in fission yeast. Curr Biol, 2001. 11(20): p. 1624-30.
7. Miyoshi, T., et al., Fission yeast Pot1-Tpp1 protects telomeres and regulates telomere length. Science, 2008. 320(5881): p. 1341-4.
8. Miyake, Y., et al., RPA-like mammalian Ctc1-Stn1-Ten1 complex binds to single-stranded DNA and protects telomeres independently of the Pot1 pathway. Mol Cell, 2009. 36(2): p. 193-206.
9. Takikawa, M., Y. Tarumoto, and F. Ishikawa, Fission yeast Stn1 is crucial for semi-conservative replication at telomeres and subtelomeres. Nucleic Acids Res, 2017. 45(3): p. 1255-1269.
10. Yamazaki, H., Y. Tarumoto, and F. Ishikawa, Tel1(ATM) and Rad3(ATR) phosphorylate the telomere protein Ccq1 to recruit telomerase and elongate telomeres in fission yeast. Genes Dev, 2012. 26: 241-246.
11. Hirai, Y., et al., NEK6-mediated phosphorylation of human TPP1 regulates telomere length through telomerase recruitment. Genes Cells, 2016. 21: 874-889.
12. Sadaie, M., T. Naito, and F. Ishikawa, Stable inheritance of telomere chromatin structure and function in the absence of telomeric repeats. Genes Dev, 2003. 17(18): p. 2271-82.
13. Nabetani, A. and F. Ishikawa, Unusual telomeric DNAs in human telomerase-negative immortalized cells. Mol Cell Biol, 2009. 29(3): p. 703-13.
14. Makoto T. Hayashi, Anthony J. Cesare, Teresa Rivera and Jan Karlseder, Cell Death During Crisis Is Mediated by Mitotic Telomere Deprotection. Nature, 2015, June 25; 522(7557): 492-496
15. Makoto T. Hayashi, Anthony J. Cesare, James A. J. Fitzpatrick, Eros Lazzerini-Denchi and Jan Karlseder, A Telomere Dependent DNA Damage Checkpoint Induced by Prolonged Mitotic Arrest. Nature Structural & Molecular Biology, 2012 Mar 11; 19(4): 387-394